






《高一年级化学必修1 第二章复习课件PPT下载》是由用户上传到老师板报网,本为文库资料,大小为446.5 KB,总共有23页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 23页
- 446.5 KB
- VIP模板
- ppt
- 数字产品不支持退货
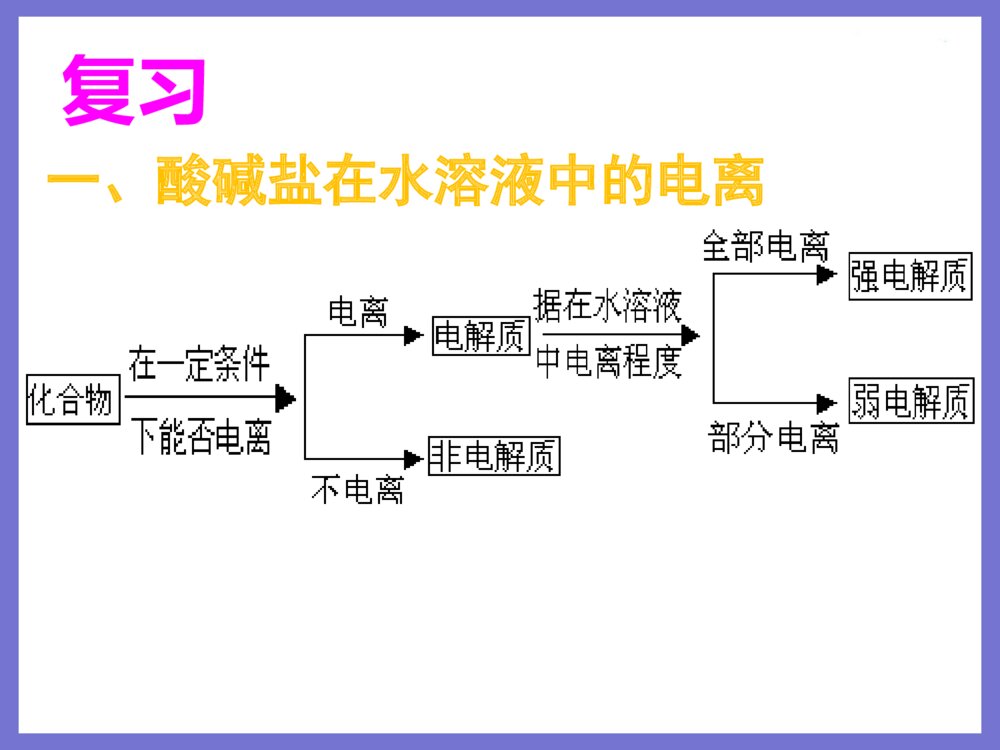
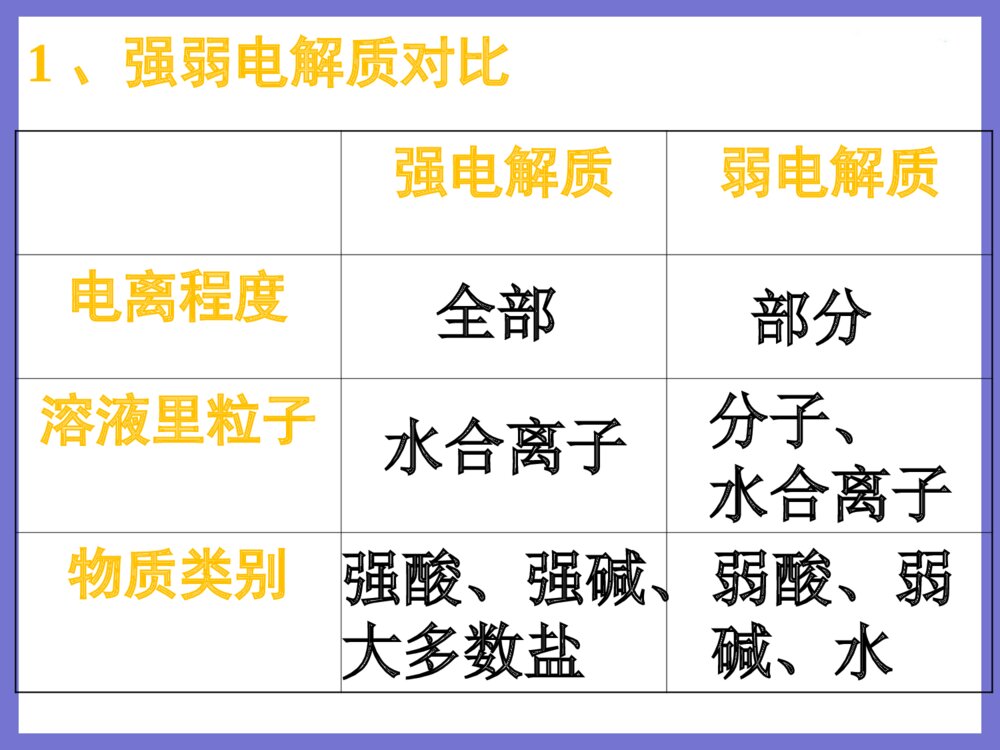
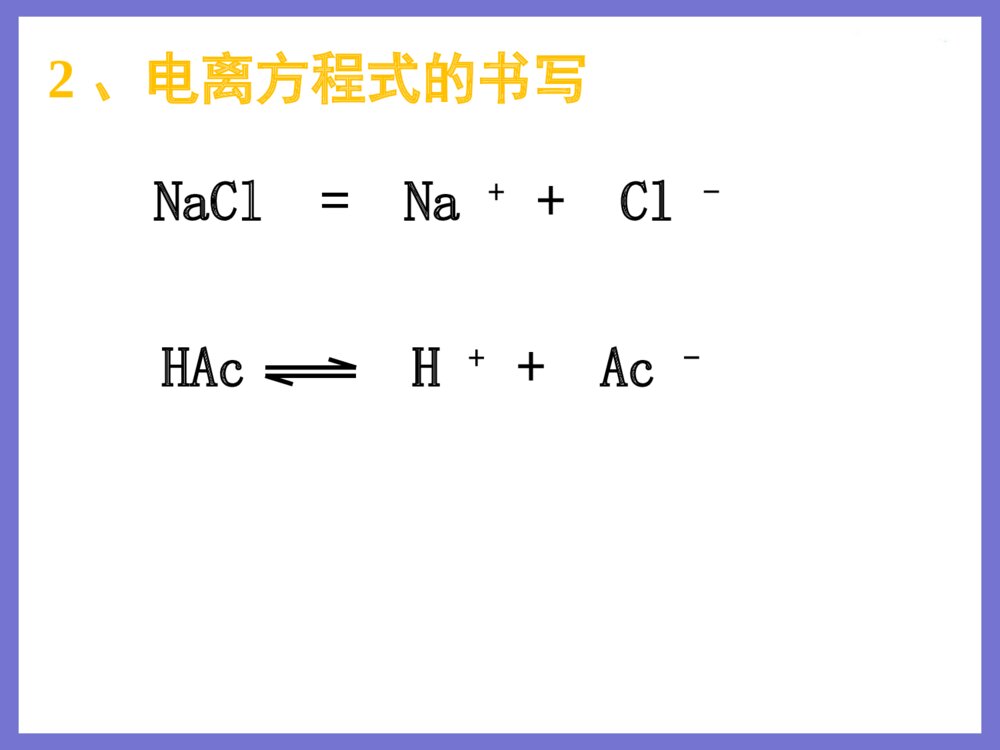
授课者:秦飞授课者:秦飞高一年级化学必修1第二章化学物质及其变化复习一、酸碱盐在水溶液中的电离强电解质弱电解质电离程度溶液里粒子物质类别全部部分水合离子分子、水合离子强酸、强碱、大多数盐弱酸、弱碱、水1、强弱电解质对比2、电离方程式的书写HAcH++Ac-NaCl=Na++Cl-二、离子反应1、离子反应的类型复分解型离子之间的交换反应氧化还原型离子参加的氧化还原反应如:溶液中的置换反应等。2、离子方程式的书写练习1.能用H++OH-=H2O来表示的化学反应是()A.氢氧化镁和稀盐酸反应B.Ba(OH)2溶液滴入稀硫酸中C.澄清石灰水和稀硝酸反应D.二氧化碳通入澄清石灰水中C练习2.下列离子方程式书写正确的是A.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++CuB.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑C.氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑A3、离子共存问题:离子之间不反应,就可以大量共存。只要离子间发生反应,就不能大量共存。(1)因生成气体而不能大量共存。如:H+与CO32-、SO32-、S2-、HCO3-等不能大量共存。(2)因生成沉淀而不能大量共存如:Ag+与Cl-、SO42-;Ba2+与CO32-、SO42-;Cu2+与OH-等。(3)因生成难电离物质(弱酸、弱碱、水等)而不能大量共存。①H+与PO43-、Ac-、ClO-等生成弱酸;②OH-与NH4+、Cu2+、Fe3+等生成弱碱;③H+与OH-生成水。(4)因发生氧化还原反应而不能大量共存Fe3+、MnO4-与I-、S2-不能大量共存练习3.在碱性溶液中能大量共存且溶液为无色透明的离子组是A.K+、MnO4-、Na+、Cl-B.K+、Na+、NO3-、CO32-C.Na+、H+、NO3-、SO42-D.Fe3+、Na+、Cl-、SO42-B1、氧化还原反应的定义定义:凡有电子转移(得失或偏移)的化学反应。实质:电子转移(微观)特征:化合价升降(宏观)氧化剂+还原剂=还原产物+氧化产物三、氧化还原反应(1)据同一反应方程式的方向氧化剂+还原剂===氧化产物+还原产物强强弱弱氧化性:氧化剂>氧化产物还原性:还原剂>还原产物2、氧化性、还原性的强弱强弱比较(2)看得失电子难易程度得电子能力越强反应越活泼氧化性越强失电子能力越强反应越活泼还原性越强据金属活动性顺序进行判断单质还原性逐渐减弱KCaNaMgAlZnFeSnPb(H)CuHgAgPtAuK+Ca2+Na+Mg2+Al3+Zn2+Fe2+Sn2+Pb2+(H+)Cu2+Hg2+Ag+阳离子氧化性逐渐增强当金属单质失去电子变成离子后,表现什么性质?性质的强弱如何?如:Na和Mg分别与盐酸反应注意:氧化(还原)性强弱,与得失电子多少无关据非金属活动性顺序进行判断单质氧化性逐渐减弱 FClBrISF-Cl-Br-I-S2-阴离子还原性逐渐增强氧化还原进行的条件练习Cl2+2HBr=2HCl+Br2Br2+2HI=2HBr+I2I2+H2S=2HI+S则物质氧化性由强到弱的顺序是_________________;物质的还原性由强到弱的顺序是_________________。Cl2>Br2>I2>SH2S>HI>HBr>HCl2.今有三个氧化还原反应:①2FeCl3+2KI=2FeCl2+2KCl+I2②2FeCl2+Cl2=2FeCl3③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而又不影响Fe2+和Cl-。可加入的试剂是()A.Cl2B.KMnO4C.FeCl3D.HClC谢谢!



















